HLA抗原基因具有高度的多态性,特别是HLA—Ⅱ类基因的第二外显子区核苷酸序列的高度变异性,产生了位数众多的等位基因,如仅HLA—DRB1位点就存在106个等位基因。HLA的多态性.决定了所表达的HLA抗原分子的多态性,也决定了HLA系统免疫反应的多样性和复杂性,HLA抗原多态性检测在医学实践和科研中具有十分重要的意义。传统的器官、组织移植配型,疾病相关性研究,人类学及法医学上的应用,为这些领域的发展提供了可靠的技术方法和有价值的资料。
HLA抗原分型过去主要采用血清学和细胞学方法。基因分型技术是继血清学和细胞学方法之后,于近年来发展起来的一种分子生物学技术,主要用于HLA—Ⅱ类基因分型,最近几年也已用于HLA—I类基因的分型。其方法学上的主要特点是能直接从基因的水平对HLA基因多态性进行分析,方法准确、灵敏,且能检出血清学和细胞学方法无法检出的基因型别。
随着PCR技术的广泛应用,基因分型方法在上述领域以及肿瘤学、生物化学等方面得到了广泛应用。许多研究HLA系统的实验室竞相运用PCR技术,结合等位基因特异的寡核苷酸(allele-specific oligonucleotide,AS0ASO)或序列特异的寡核苷酸探针(sequence-specific oligonucleotide probes, SSO)对HLA系统进行DNA分型。DNA分型适用于任何有核细胞,显示的结果与血清或细胞学分型结果高度对应。而且能够发现血清学或细胞学方法不能检测的额外特异性,有助于进一步研究HLA系统基因的结构和功能。
随着上世纪90年代中期生物芯片技术的出现和发展,一种快速的、高通量的基因分型技术又应运而生了。这对于解决大样本量的供受配型问题提供了一个强有力的工具。中华红十字总会计划在2003年底前建设一个库容为10万人份的骨髓库以满足骨髓移植的临床需要。如此大的样本量需要一个快速、高效的分型方法提供技术支持。“复旦张江”自2000年6月开始“人类白细胞抗原(Human Leucocyte Antigen,HLA)分型基因芯片”的研发工作。至今,此项目已进行了3年并取得了成功,开发出一套试剂盒用于HLA分型。该产品的研发成功进一步填补的国内在该技术领域的空白。
下面就按照方法的发展简要叙述不同的HLA分型技术并进行优劣比较:
血清学分型技术
(一)HLA-Ⅰ类抗原的检测
HLA-A、B、C抗原型别鉴定均借助微量淋巴细胞毒试验(microlymphocytotoxicity test)或称补体依赖的细胞毒试验(complement dependent cytotoxicity test)。原理为取已知HLA抗血清加入待测外周血淋巴细胞,作用后加入免兔补体,充分作用后加入染料,在倒置显微镜下判断结果,着染的细胞为死亡细胞,表示待检淋巴细胞表面具有已知抗血清所针对的抗原。(具体操作流程见 图1)标准抗原清血清取自多次经产妇或计划免疫志愿者。
图1 血清学分型技术操作流程
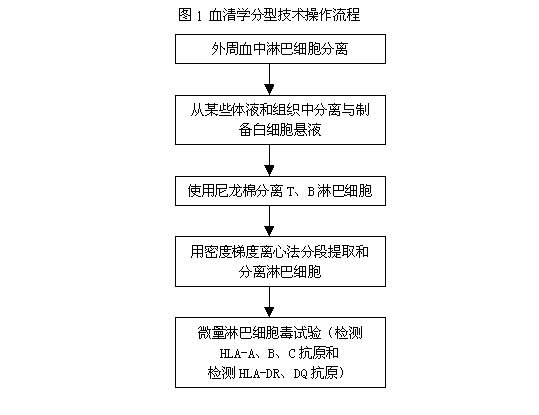
(二)HLA-DR、DQ抗原检测
该二抗原分型方法同HLA-Ⅰ类抗原,但所用抗血清须经过血小板吸收以去除针对Ⅰ类抗原的抗体。另外,待测细胞须是经纯化的B细胞。
血清学分型是一项古老的技术,虽然近年来已建立许多新的分型技术,但血清学方法目前仍是HLA分型的基础。
细胞学分型技术
HLA-Dw特异性与HLA-DP特异性可分别通过纯合分型细胞(homozygote typing cell, HTC)及预致敏淋巴细胞试验(primed lymphocyte test, PLT)检测。二种方法的基本原理均是判断淋巴细胞在识别非已HLA抗原决定簇后发生的增殖反应。由于分型细胞来源困难以及操作步骤(图2)繁琐,细胞学分型技术下正逐渐淘汰。
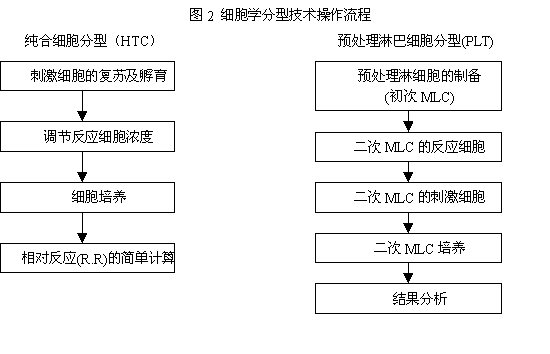
HLA的基因分型技术
上述传统的HLA分型方法有许多不足之处,近年来国内外已将HLA分型技术由抗原水平发展到基因水平。
(一)限制性片段长度多态性检测技术
这是首先建立的对多态性进行检测的DNA分析技术。个体间抗原特异性来自氨基酸顺序的差别,后者由编码基因的碱基顺序不同所决定。这种碱基顺序的差别造成限制性内切酶识识别位置及酶切位点数目的不同,从而产生数量和长度不一的DNA酶切片段。用特异性探针对整个基因组DNA酶切片段进行杂交,即可分析限制性长度片段多态性(restriction fragment length polymorphism, RFLP)。一定的内切酶组合所得到的HLA-RFLP可以和传统方法测定的HLA特异性型别相关。80年代末发展起来的PCR(polymerase chain reaction)技术已被用于RFLP分析,即用等位特异限制酶裂解PCR扩增的片段,然后再进行分析,从而大提高了灵敏度。
(二)PCR/SSO技术
此法乃用人工合成的HLA型别特异的寡核苷酸序列作为探针,与待检细胞经PCR扩增的HLA基因片段杂交,从而确定HLA型别,PCR技术可将HLA复合体上指定基因片段特异性地扩增5~6个数量级;而专门设计的SSO(序列特异的寡核苷酸sequence specific oligonucleotide)探针又能探测出等位基因间1~2个核苷酸的差异,故PCR/SSO技术具有灵敏度、特异性强、需样本量少等优点。
正相SSO是将PCR产物集中点在多张尼龙膜上,然后用各个探针分别与一张膜杂交;反相SSO又称反相杂交条(RBS或RLB),是将探针集中点在一张尼龙膜上,然后用各标本的PCR产物分别与膜杂交。前者能根据各探针的特点选择各自的最适条件杂交,信号强度可控,但操作较繁琐,样本量不大时工作效率较低。后者对大样本工作效率较高,成本也低,是适合骨髓库分型的首选方法。
(三)PCR/SSP技术
目前常规的HLA-DNA分型技术,包括上述的PCR/RFLP、PCR/SSO等,最终均需用标记的特性探针与扩增产物进行杂交,再分析结果。PCR/SSP方法用乃设计出一整套等位基因组特异性引物(sequence specific primer, SSP),借助PCR技术获得HLA型别特异的扩增产物,可通过电泳直接分析带型决定HLA型别,从而大大简化了实验步骤。
由于传统方法在Ⅱ类抗原分型方面困难较大,故上述几种基因分析型方法目前主要用于Ⅱ类基因座。此外,目前已建立的HLA基因分型技术还包括PCR单链构像多态性分析(PCR-single strand conformational polymorphism,PCR-SSCP)和PCR异源二聚体电泳多态即PCR指纹图(PCR fingerprinting)分析。
(四)SBT技术
SBT 实际上是基因测序技术在HLA分型上的应用。SBT是公认最准确的分型方法,也是IHWG认证HLA新等位基因所要求的唯一方法。SBT可以直接用PCR产物测序,但部分杂合子状态会产生含混结果(ambiguity)。解决的办法之一是用组特异性引物(group specific primers)扩增(相当于低分辨率SSP)并测序,另一种办法是对PCR产物克隆后测序。这样,就使得SBT方法非常麻烦,而且测序费用很高,测序仪价格昂贵,所以难以广泛使用。
HLA分型技术比较
DNA分型技术的应用,使HLA型别分析达到了更精细的水平,并因此发现了更多的HLA多态性。HLA的DNA分型技术现已成为血清学方法的竞争者,并可能在不久的将来完全取而代之。下表(表1)将现有的三大类分型技术作简单比较从而更能够凸现出基因分型方法的优势。
表1 HLA分型方法的比较
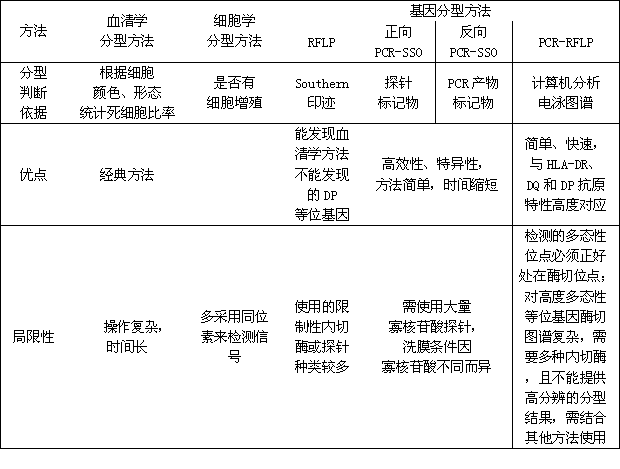
基因分型方法作为一类以DNA序列差别为基础的分型方法,包括PCR-SSO(正相或反相)、PCR-SSP、SBT等,其特点及技术原理上文已经详述,下面想就这一大类的分型技术从操作的简便性、分型效率等角度作比较:
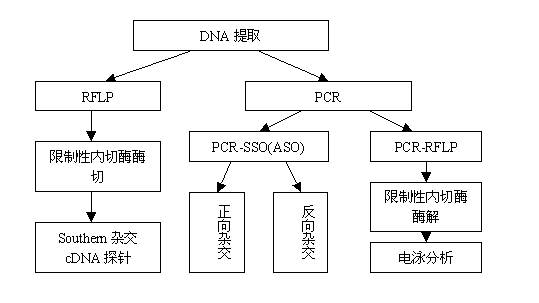
图3 不同基因分型技术的操作流程
从图3的操作流程中我们不难发现RFLP技术的精度略低、操作流程较为复杂且不利于大容量样本的分型工作,现已很少采用。而SSP技术尽管操作简便但是难以达到高分辨,大样本操作同样有困难。基于基因测序技术的SBT方法操作极为复杂而且测序费用很高、测序仪价格昂贵,所以性价比不适合国内广泛开展。下表(表2)从可操作性、实验周期、大样本效率、准确性、分辨率、重复性、稳定性、客观性、对标本要求、设备要求、价格等角度对临床上常用的5类分型技术进行比较,力求客观地评价各类技术及其适用性。
表2 常用的HLA分型方法的比较
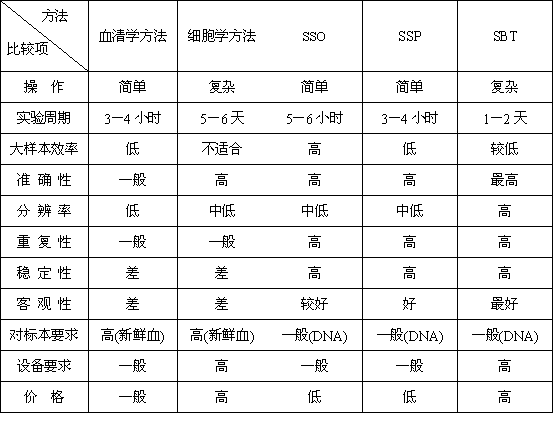
从上述比较可以看出SSO的性价比显然较高、同时在可操作性上也有相当的优势。因此反向SSO是最适合大规模HLA分型的价廉物美的方法,也是国际组织相容性工作组(IHWG)和美国骨髓捐献者计划(NMDP)等权威机构的常规方法。
该方法借鉴了基因芯片的工作原理——在一个微小的芯片上构建成千上万不同的DNA的生物分子微阵列及流体分析系统,对等位基因进行准确、快速、大规模的测定和分析。实际上,它就是将生命科学研究中许多不连续的实验步骤——样品制备、生化反应和结果检测及分析等集中到芯片上进行(图1),使其连续化、微型化。
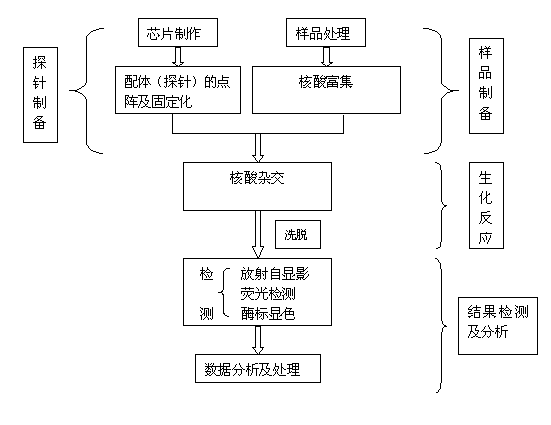
图4 基因芯片的分析步骤
反向SSO即采用特异的PCR引物将待测基因的主要变异区扩增出来,与固定在载体上的SSO探针杂交,最后根据杂交形成的探针格局(pattern)对不同的等位基因加以区分。实际与基因芯片的原理一致,因此工作效率极高。
|

 沪ICP备10027510号-1
沪ICP备10027510号-1