HLA抗原基因具有高度的多態性,特別是HLA—Ⅱ類基因的第二外顯子區核苷酸序列的高度變異性,產生了位數眾多的等位基因,如僅HLA—DRB1位點就存在106個等位基因。HLA的多態性.決定了所表達的HLA抗原分子的多態性,也決定了HLA系統免疫反應的多樣性和複雜性,HLA抗原多態性檢測在醫學實踐和科研中具有十分重要的意義。傳統的器官、組織移植配型,疾病相關性研究,人類學及法醫學上的應用,為這些領域的發展提供了可靠的技術方法和有價值的資料。
HLA抗原分型過去主要採用血清學和細胞學方法。基因分型技術是繼血清學和細胞學方法之後,於近年來發展起來的一種分子生物學技術,主要用於HLA—Ⅱ類基因分型,最近幾年也已用於HLA—I類基因的分型。其方法學上的主要特點是能直接從基因的水準對HLA基因多態性進行分析,方法準確、靈敏,且能檢出血清學和細胞學方法無法檢出的基因型別。
隨著PCR技術的廣泛應用,基因分型方法在上述領域以及腫瘤學、生物化學等方面得到了廣泛應用。許多研究HLA系統的實驗室競相運用PCR技術,結合等位基因特異的寡核苷酸(allele-specific oligonucleotide,AS0ASO)或序列特異的寡核苷酸探針(sequence-specific oligonucleotide probes, SSO)對HLA系統進行DNA分型。DNA分型適用於任何有核細胞,顯示的結果與血清或細胞學分型結果高度對應。而且能夠發現血清學或細胞學方法不能檢測的額外特異性,有助於進一步研究HLA系統基因的結構和功能。
隨著上世紀90年代中期生物芯片技術的出現和發展,一種快速的、高通量的基因分型技術又應運而生了。這對於解決大樣本量的供受配型問題提供了一個強有力的工具。中華紅十字總會計畫在2003年底前建設一個庫容為10萬人份的骨髓庫以滿足骨髓移植的臨床需要。如此大的樣本量需要一個快速、高效的分型方法提供技術支援。“復旦張江”自2000年6月開始“人類白細胞抗原(Human Leucocyte Antigen,HLA)分型基因芯片”的研發工作。至今,此專案已進行了3年並取得了成功,開發出一套試劑盒用於HLA分型。該產品的研發成功進一步填補的國內在該技術領域的空白。
下面就按照方法的發展簡要敘述不同的HLA分型技術並進行優劣比較:
血清學分型技術
(一)HLA-Ⅰ類抗原的檢測
HLA-A、B、C抗原型別鑒定均借助微量淋巴細胞毒試驗(microlymphocytotoxicity test)或稱補體依賴的細胞毒試驗(complement dependent cytotoxicity test)。原理為取已知HLA抗血清加入待測外周血淋巴細胞,作用後加入免兔補體,充分作用後加入染料,在倒置顯微鏡下判斷結果,著染的細胞為死亡細胞,表示待檢淋巴細胞表面具有已知抗血清所針對的抗原。(具體操作流程見 圖1)標準抗原清血清取自多次經產婦或計畫免疫志願者。
圖1 血清學分型技術操作流程
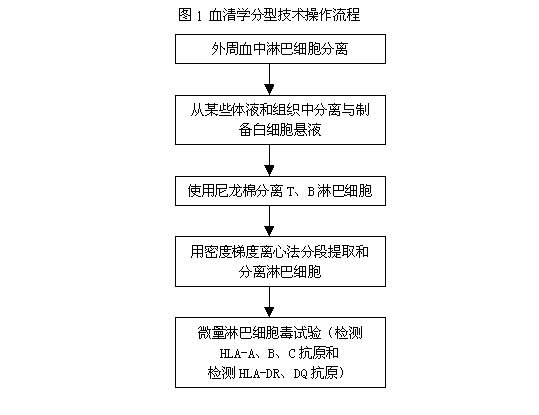
(二)HLA-DR、DQ抗原檢測
該二抗原分型方法同HLA-Ⅰ類抗原,但所用抗血清須經過血小板吸收以去除針對Ⅰ類抗原的抗體。另外,待測細胞須是經純化的B細胞。
血清學分型是一項古老的技術,雖然近年來已建立許多新的分型技術,但血清學方法目前仍是HLA分型的基礎。
細胞學分型技術
HLA-Dw特異性與HLA-DP特異性可分別通過純合分型細胞(homozygote typing cell, HTC)及預致敏淋巴細胞試驗(primed lymphocyte test, PLT)檢測。二種方法的基本原理均是判斷淋巴細胞在識別非已HLA抗原決定簇後發生的增殖反應。由於分型細胞來源困難以及操作步驟(圖2)繁瑣,細胞學分型技術下正逐漸淘汰。
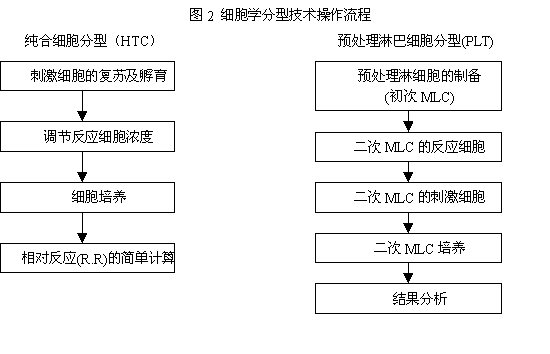
HLA的基因分型技術
上述傳統的HLA分型方法有許多不足之處,近年來國內外已將HLA分型技術由抗原水準發展到基因水準。
(一)限制性片段長度多態性檢測技術
這是首先建立的對多態性進行檢測的DNA分析技術。個體間抗原特異性來自氨基酸順序的差別,後者由編碼基因的堿基順序不同所決定。這種堿基順序的差別造成限制性內切酶識識別位置及酶切位元點數目的不同,從而產生數量和長度不一的DNA酶切片段。用特異性探針對整個基因組DNA酶切片段進行雜交,即可分析限制性長度片段多態性(restriction fragment length polymorphism, RFLP)。一定的內切酶組合所得到的HLA-RFLP可以和傳統方法測定的HLA特異性型別相關。80年代末發展起來的PCR(polymerase chain reaction)技術已被用於RFLP分析,即用等位特異限制酶裂解PCR擴增的片段,然後再進行分析,從而大提高了靈敏度。
(二)PCR/SSO技術
此法乃用人工合成的HLA型別特異的寡核苷酸序列作為探針,與待檢細胞經PCR擴增的HLA基因片段雜交,從而確定HLA型別,PCR技術可將HLA複合體上指定基因片段特異性地擴增5~6個數量級;而專門設計的SSO(序列特異的寡核苷酸sequence specific oligonucleotide)探針又能探測出等位基因間1~2個核苷酸的差異,故PCR/SSO技術具有靈敏度、特異性強、需樣本量少等優點。
正相SSO是將PCR產物集中點在多張尼龍膜上,然後用各個探針分別與一張膜雜交;反相SSO又稱反相雜交條(RBS或RLB),是將探針集中點在一張尼龍膜上,然後用各標本的PCR產物分別與膜雜交。前者能根據各探針的特點選擇各自的最適條件雜交,信號強度可控,但操作較繁瑣,樣本量不大時工作效率較低。後者對大樣本工作效率較高,成本也低,是適合骨髓庫分型的首選方法。
(三)PCR/SSP技術
目前常規的HLA-DNA分型技術,包括上述的PCR/RFLP、PCR/SSO等,最終均需用標記的特性探針與擴增產物進行雜交,再分析結果。PCR/SSP方法用乃設計出一整套等位基因組特異性引物(sequence specific primer, SSP),借助PCR技術獲得HLA型別特異的擴增產物,可通過電泳直接分析帶型決定HLA型別,從而大大簡化了實驗步驟。
由於傳統方法在Ⅱ類抗原分型方面困難較大,故上述幾種基因分析型方法目前主要用於Ⅱ類基因座。此外,目前已建立的HLA基因分型技術還包括PCR單鏈構像多態性分析(PCR-single strand conformational polymorphism,PCR-SSCP)和PCR異源二聚體電泳多態即PCR指紋圖(PCR fingerprinting)分析。
(四)SBT技術
SBT 實際上是基因測序技術在HLA分型上的應用。SBT是公認最準確的分型方法,也是IHWG認證HLA新等位基因所要求的唯一方法。SBT可以直接用PCR產物測序,但部分雜合子狀態會產生含混結果(ambiguity)。解決的辦法之一是用組特異性引物(group specific primers)擴增(相當於低解析度SSP)並測序,另一種辦法是對PCR產物克隆後測序。這樣,就使得SBT方法非常麻煩,而且測序費用很高,測序儀價格昂貴,所以難以廣泛使用。
HLA分型技術比較
DNA分型技術的應用,使HLA型別分析達到了更精細的水準,並因此發現了更多的HLA多態性。HLA的DNA分型技術現已成為血清學方法的競爭者,並可能在不久的將來完全取而代之。下表(表1)將現有的三大類分型技術作簡單比較從而更能夠凸現出基因分型方法的優勢。
表1 HLA分型方法的比較
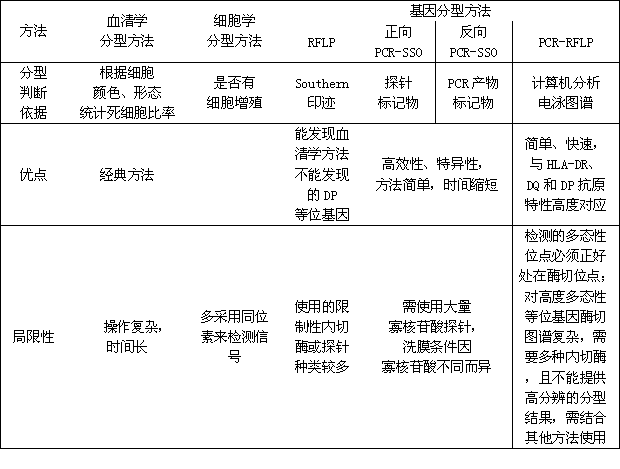
基因分型方法作為一類以DNA序列差別為基礎的分型方法,包括PCR-SSO(正相或反相)、PCR-SSP、SBT等,其特點及技術原理上文已經詳述,下面想就這一大類的分型技術從操作的簡便性、分型效率等角度作比較:
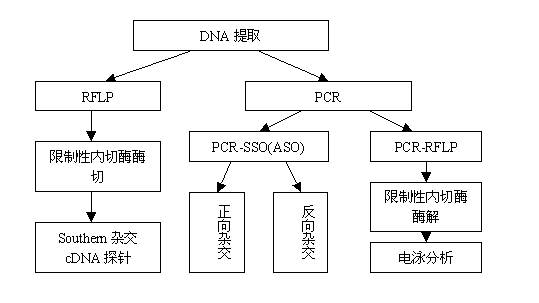
圖3 不同基因分型技術的操作流程
從圖3的操作流程中我們不難發現RFLP技術的精度略低、操作流程較為複雜且不利於大容量樣本的分型工作,現已很少採用。而SSP技術儘管操作簡便但是難以達到高分辨,大樣本操作同樣有困難。基於基因測序技術的SBT方法操作極為複雜而且測序費用很高、測序儀價格昂貴,所以性價比不適合國內廣泛開展。下表(表2)從可操作性、實驗週期、大樣本效率、準確性、解析度、重複性、穩定性、客觀性、對標本要求、設備要求、價格等角度對臨床上常用的5類分型技術進行比較,力求客觀地評價各類技術及其適用性。
表2 常用的HLA分型方法的比較
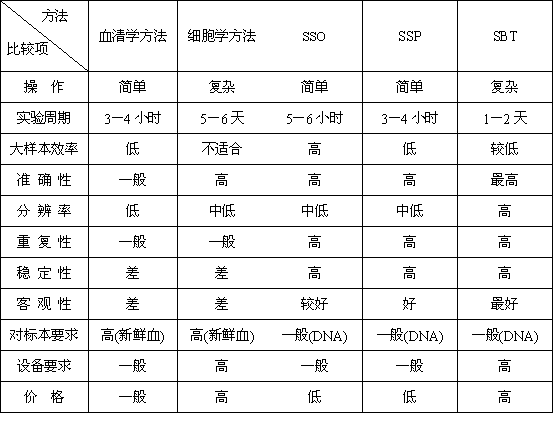
從上述比較可以看出SSO的性價比顯然較高、同時在可操作性上也有相當的優勢。因此反向SSO是最適合大規模HLA分型的價廉物美的方法,也是國際組織相容性工作組(IHWG)和美國骨髓捐獻者計畫(NMDP)等權威機構的常規方法。
該方法借鑒了基因芯片的工作原理——在一個微小的芯片上構建成千上萬不同的DNA的生物分子微陣列及流體分析系統,對等位元基因進行準確、快速、大規模的測定和分析。實際上,它就是將生命科學研究中許多不連續的實驗步驟——樣品製備、生化反應和結果檢測及分析等集中到芯片上進行(圖1),使其連續化、微型化。
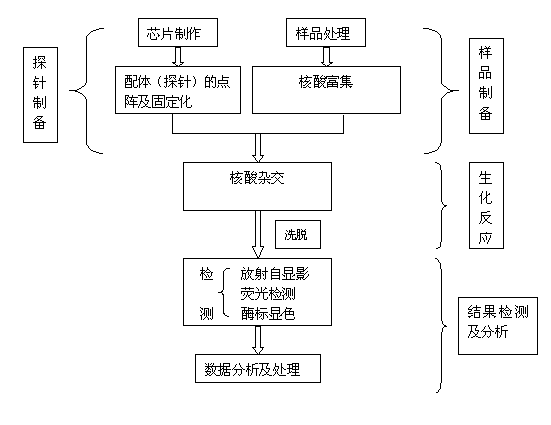
圖4 基因芯片的分析步驟
反向SSO即採用特異的PCR引物將待測基因的主要變異區擴增出來,與固定在載體上的SSO探針雜交,最後根據雜交形成的探針格局(pattern)對不同的等位基因加以區分。實際與基因芯片的原理一致,因此工作效率極高。
|

 沪ICP备10027510号-1
沪ICP备10027510号-1